TRANSDUCCIÓN DE SEÑALES
VISION
Como la fotosíntesis, la primera etapa en el proceso de la visión es la absorción de energía luminosa. El cromóforo que absorbe la luz visible es el aldehído de vitamina A, o retinal.
La visión es un proceso por el cual la luz que incide sobre la retina se convierte en impulsos eléctricos que se transmiten al encéfalo. Los impulsos producidos por la luz que llegan a los fotorreceptores son transmitidos al cerebro por una red en impulsos nerviosos. La conversión de la luz incidente en impulsos nerviosos se llama transducción y comprende dos pasos básicos:
Paso1, que consiste en una reacción fotoquímica que ocurre en el segmento externo de los conos y bastones cuando la energía luminosa absorbida causa cambios conformacionales en los cromóforos, las moléculas de opsina activadas interaccionan con una proteína G llamada transducina. Después la tansducina activa una fosfodiesterasa que degrada GMP cíclico (cGMP). En la penumbra se producen concentraciones elevadas de cGMP en los fotoreceptores en la superficie citoplasmática de los canales de Na+, lo que hace que se mantengan abiertos, en consecuencia, los fotoreceptores tienen un potencial de membrana bajo.
Paso2, que consiste en una disminución de la concentración de cGMP dentro del citoplasma del segmento interno de los fotoreceptores. Estos cambios, que son activados por la energía luminosa, disminuyen la permeabilidad de la membrana plasmática al Na+. Cuando hay menos moléculas de cGMP unidas a las proteínas de canal de Na+ se produce la hiperpolarización del fotoreceptor cuya consecuencia es una reducción de la secreción de neurotrasmisores (glutamato). Esta disminución de la secreción de glutamato es detectada por las células bipolares de la retina, que inicia impulsos eléctricos que son transmitidos al cerebro.
(fig.5.8)
Mecanismo molecular de la percepción, el extremo carboxil terminal de la opsina está conectado con una proteína G. a diferencia de los fotoreceptores β-adrenérgicos, la subunidad α de la proteína G de los discos de los bastones actúa sobre cGMP-fosfodiesterasa, en lugar del adenilato ciclasa. La activación de la rodopsina por un fotón desarrolla una reacción en cascada que puede ser descrita de la siguiente manera. La rodopsina fotoactivada colisiona con la proteína G a consecuencias de los cual se libera la subunidad α ligada a GTP esta subunidad es capas de activar una cGMP-fofodiesterasa inactiva, que catalizaría la transformación de cGMP en GMP (ver fig5.7). Se ha demostrado que la percepción de un fotón afecta a varios cientos de moléculas de cGMP. No hay que olvidar que la percepción de un fotón implica la disociación de todo tras retinal de su opsina modificada.
En los bastones la energía de la luz absorbida causa cambios conformacionales del retinal, que se conviente en retinol.
Luz visible
Comprende de los 400nm (rojo extremo) y unos 700nm (violeta subido), los limites no son precisos ya que las variaciones individuales en la capacidad de detectar longitudes de ondas extremas; esta capacidad también disminuye con la edad.
Issac Newton (1642-1727) fue el primer en registrar la separación de la luz solar en sus colores componentes haciéndola pasar por un prisma de vidrio. Como la luz solar (luz blanca) posee todas las longitudes de onda de luz visible, esta da el espectro continuo que se observa en un arcoíris (figura 5.13a). La luz visible sólo representa un segmentó muy estrecho del espectro de radiación electromagnética (figura5.13b).además de todas las longitudes de onda de la luz visible, la luz solar se compone de radiación de longitud de onda más corta (ultravioleta) y de longitud de onda más larga (infrarroja). El ojo humano no detecta a ninguna de ellas y ambas pueden detectarse y registrarse por medios fotográficos o mediante detectores diseñados para este
fin.
El ojo y las células fotoreceptoras
La retina del ojo tiene unos 100 millones de células en forma de bastón, y 5 millones de células en forma de cono. Entre las células y las fibras nerviosas que van al cerebro están las sinapsis, o conexiones (figura19.16). El retinal se asocia con una proteína llamada opsina. Existen cuatro tipos distintos de opsina, una en las células en forma de bastón y tres células en forma de cono. Los complejos cromóforo-opsina de los bastones y los conos se llaman rodopsina y yodopsina, respectivamente, como resultado de una investigación dirigida por el biólogo estadounidense George Wald (1906-1997) y otros, ahora se comprende bastante bien el mecanismo básico de la visión.
Fotoquímica de la visión
Los cambios que suceden después de la excitación por la luz son básicamente los mismos en la rodopsina y la yodopsina, y son una isomerización del cromóforo, de cis a trans.
La figura 19.17 muestra los isómeros geométricos11-cis-retinal. En realidad, es posible que exista un total de seis isómeros geométricos, pero sólo estos dos tienen importancia en el proceso de la visión. La luz solo sirve para iniciar la isomerización del 11-cis–retinal a todo-trans-retinal. Esta es la diferencia fundamental entre la acción de la luz en la visión y, su papel en la fotosíntesis. En esta ultima, la energía luminosa se usa en el trabajo químico para impulsar los electrones en contra de un gradiente electroquímico y sintetizar moléculas de ATP y NADPH. En la visión no hay pruebas que sugieran que la energía luminosa causa síntesis química. Las fibras nerviosas sobre las cuales actúa la luz están listas para descargarse porque ya se habían cargado antes por las reaccioné química sin relación alguna con la excitación del cromóforo.la luz solo se necesita para disipar su descarga.
Estructura de la rodopsina
La opsina es una proteína con masa molar aproximada de 38000daltons. En la rodopsina el grupo aldehído del 11- cis-retinal forma una base de Schiff con el grupo amino de lisina en la opsina:
Como podemos ver en la figura 19.18, la formación de la base de Schiff protonada (al pasar del 11-cis-retinal a rodopsina) desplaza la absorción, de λmax a unos 380nm del 11-cis-retinal, hasta unos 500nm. La absorcividad molar de la rodopsina es de unos 40 000 Lmol-cm-1, que se debe a la extensa conjugación electrónica π en la molécula del retinal.
Visión a color
Los bastones poseen el pigmento visual rodopsina, mientras que los conos contiene el pigmento llamado yodopsina.
La yodopsina (purpura visual) de los bastones inicia el estimulo visual cuando se decolora con la luz. Esta sustancia esta presente en forma globular sobre la superficie externa de la bicapa lipidica (o sea, en el lado citoplasmático) de los discos membranosos. En los conos el pigmento visual de los discos membranosos es el fotopigmento yodopsina. Cada cono esta especializado para responder al máximo ante uno de tres colores rojo, verde o azul. Tanto la rodopsina como la yodopsina poseen una subunidad fijada a la membrana que se denomina opsina y un segundo componente que se conoce como cromóforo. La opsina de los bastones es la escoptosina mientras que las opsinas de lo conos se llaman fotopsinas. El cromóforo de los bastones es un carotenoide derivado de la vitamina A cuyo nombre es el retinal. En consecuencia para tener una visión normal es indispensable una cantidad adecuada de vitamina A, la defeciencia de esta vitamina causa un transtono de la visión en la penumbra (“ceguera nocturna”).
Mecanismo de la visión
Los primeros estudios in vitro demostraron que cuando la retina se expone a la luz, la rodopsina se descompones en opsina y el isómero todo trans del retinal. Como la rodopsina puede regenerarse uniendo opsina con 11-cis-retinal en la obscuridad, la conclusión fue que la luz provoca la isomerización del retinal, respecto a su doble enlace del C-11 al C12 (figura19.19). Mediante experimentos basados en impulsos contos de laser sea demostrado que la excitación inicial de la rodopsina produce una especie llamada batorodopsina que es la forma tensionada toda trans del retinal (figura19.20).las duveras características de estas distintas especies transitorias se deben a sus distintas conformaciones y distribuciones de carga. Al final, en un proceso catalizado por enzima, el todo –trans-retinal se isomeriza en la obscurada a 11-cis-retinal, que entonces forma la base de schiff para regenerar la rodosina.

La sensación de ver sucede en la formación de la metarodopsina II, que dispara una cascada enzimática que provoca el cierre de canales específicos para cationes, y la regeneración de una señal nerviosa. Esta señal se transmite al cerebro, donde se procesa y se transforma en una imagen visual.
Rotación sobre el enlace C=C
Para poder comprender mejor la isomerización del 11-cis-retinal a todo-trans-retinal, examinaremos los cambios de energía en el proceso. Para comenzar se nota que la rotación hacia un enlace sencillo C-C, como el del etano, es bastante libre, solo hay una pequeña barrera de rotación, de unos 10kJmol-, debida al impedimento esferico entre los átomos de hidrogeno con los átomos de carbono adyacente. Sin embargo, en este caso de moléculas que contienen enlaces C=c, la rotación esta limitada por la presencia de un enlace π entre los dos átomos de carbón además del enlace σ. en este caso la rotación restringida da lugar al fenómeno de isomería geométrica. La figura 19.21 muestra los pasos de la ruptura y restablecimiento del enlace en la isomerización de cis a trans. La energía de activación de esta reacción, es típicamente del orden de 120kJmol-. Los métodos tradicionales para obtener una isomerización geométrica son calentamiento, irradiación o catálisis química.
La fotoisomerización puede causar un cambio de cis a trans, o de trans a cis. Entonces la irradiación prolongada de alguno de los isómeros produce un cambio estable de relación cis a trans. El valor real de esta relación depende de la absorcividad molar de cada isómero y la longitud de onda de la radiación. La fotoexitación del enlace C=C da como resultado la transición de π→π*. La molécula puede estar en el primer estado singulete excitado, o en el estado triplete mas bajo. La figura 19.22 muestra un diagrama simplificado de la energía potencial de los estados fundamental y excitados de la rodopsina en función de la rotación entorno al los enlaces de carbono 11 y el carbono 12. Un ángulo de rotación de 0° corresponde al 11cis-retinal en la rodopsina antes de la absorción de la luz, mientras que 180° corresponde a la forma toda trans (batorodopsina). Observe las energías potenciales relativas de estas dos especies. En solución, en estado libre, el 11-cis-retinal es menos estable que el isómero todo trans, debido a la interacción esférica entre el grupo metilo del carbono 13 y el átomo de hidrogeno del carbono10 del isómero cis. En la rodopsina la interacción entre el 11-cis-retinal y la opsina es más favorable. La energía potencial del estado excitado es mínima cuando el ángulo de rotación es 90° (véase también la figura 19.21). Por ultimo,

El estado excitado se relaja hacia el estado fundamental que puede ser batorodopsina o el 11-cis-retinal original. Las mediciones indican que dos tercios de las veces, el singlete que se forma después de la excitación inicial es batorodopsina.
Es interesante que en ausencia de la luz, la isomerización del retinal, cis a trans solo se da cada mil años en la temperatura fisiológica de 37°C. Por ello prácticamente no hay nivel de “ruido” de fondo en nuestra percepción de la luzesto es importante debido a que la sensibilidad del ojo humano por lo alta, pues solo se requieren 5 a 6 fotones para excitar la sensación de ver.
Percepción
La rodopsina funciona a baja intensidad de la luz, por ejemplo por la noche. No puede distinguir los colores porque solo tiene un solo pigmento. Tres tipos de yodopsina que contienen los pigmentos que absorben la luz a λmáx= 426nm (azul), 530nm (verde) y 560nm (amarillo) son los responsables de la visión de colores de las células conicas. El pigmento con su máximo a 560nm extiende su sensibilidad a la región de mayores longitudes de onda, para permitir y también la sensación visual del rojo. Los conos son mucho menos sensibles a la luz, que los bastones, por lo que a la luz mortecina, todos los objetos aparecen como sombras grises. (Ver fig.5.6)

Además de los humanos. Los primates, peces óseos y aves poseen células cónicas, y pueden percibir cuando menos algunos colores. Las retinas de los gatos y bovinos, por otro lado, contienen principalmente células en bastón, por consiguiente se dice que estos animales son ciegos al color.
Entre los sistemas de fotorreceptores modernos más desarrollados se encuentra el ojo compuesto de los artrópodos, el ojo del pulpo y el ojo de los vertebrados.
Tanto para las aves como para los mamíferos primates, el ojo aporta la mayor parte de la información necesaria sobre el ambiente. La capa externa transparente del ojo es la córnea, detrás de la cual se encuentra el cristalino. La imagen es enfocada sobre la retina sensible a la luz por la córnea y por cambios de conformación del cristalino producidos por los músculos ciliares. La luz pasa a través del globo ocular a la retina, que contiene células fotorreceptoras densamente compactadas: los bastones y los conos. Los bastones, que son más sensibles a la luz que los conos, son responsables de la visión nocturna; los conos proveen mayor resolución que los bastones y son responsables de la visión en color. Las aves y los primates tienen áreas de la retina especializadas en la visión aguda conocida como fóvea.
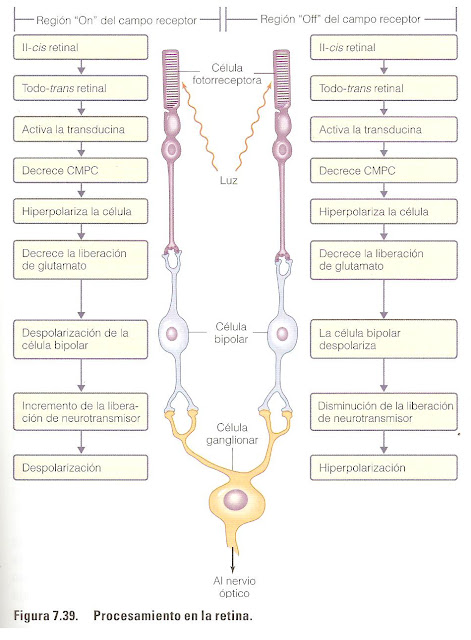
La fotorrecepción depende de la estimulación de pigmentos sensibles a la luz en los fotorreceptores; estos pigmentos están formados por moléculas resultantes de la unión entre el retinal y la proteína opsina. La estimulación provoca cambios en la permeabilidad de la membrana de los fotorreceptores, alterando su liberación de neurotransmisores a las células bipolares con las que hacen sinapsis y, por lo tanto, alterando la liberación de neurotransmisores de las células bipolares a las células ganglionares. Los cambios en el patrón de descarga de los potenciales de acción por las células ganglionares, cuyos axones forman el nervio óptico, llevan la información al cerebro.
Córdoba Vicente Carlos & González Legaz M. Estrella. Biofísica editorial síntesis, 1992, España.cap5
Raymond Chang, 2008. Fisicoquímica para la ciencia química y biológica. México; Mc Graw-Hill Interamericana.cap19
Michael H. Ross (†), Wojciech Pawlina, 2007 Texto y atlas color con biología celular y molecular, 5aedición, Ed. medica panamericana, México. Cap. 24
Whitten, K. W. [et al]. Química 8a. Ed. Cengage learning, México2008 cap.5
GUSTO
La lengua y los receptores gustativos

La lengua es un órgano muscular que se proyecta dentro de la cavidad oral desde su superficie inferior.los músculos linguales son tanto extrínsecos (con un punto de inserción fuera de la lengua) como intrínsecos (confinados por completo dentro del órgano, sin inserción externa). El musculo estriado de la lengua está organizado en fascículos que por lo general se hallan dispuestos en tres planos más o menos perpendiculares entre si. Esta distribución de las fibras musculares permite una enorme flexibilidad y una gran precisión en los movimientos de la lengua, que son indispensables para el habla humana, así como en la digestión local y la deglución. Esta forma de organización muscular es exclusiva de la lengua, lo que permite la fácil identificación de este tejido como musculo lingual. Entre los grupos de fibras musculares hay cantidades variables de tejido adiposo.
La superficie dorsal de la lengua esta dividida anatómicamente por una depresión en forma de V, el surco terminal, en dos tercios anteriores y un tercio posterior. El vértice de la V apunta hacia atrás y el sitio donde se halla el foramen (agujero) ciego, un resto embrionario del conducto tirogloso que en los comienzos del desarrollo intrauterino prolifero en la profundidad desde el piso de la faringe para formar la glándula tiroides.
La superficie dorsal de la lengua esta cubierta de papilas numerosas irregularidades y sobreelevaciones de la mucosa llamadas papilas linguales cubren la superficie dorsal de la lengua por delante del surco terminal. Las papilas linguales y sus corpúsculos gustativos asociados constituyen la mucosa especializada de la cavidad oral.
Los corpúsculos gustativos están presentes en las papilas fungiformes, caliciformes y foliadas. El gusto es una clase de sensibilidad en la cual diversas sustancias químicas estimulan a las células neuroepiteliales de los corpúsculos gustativos.
El gusto se clasifica como una sensibilidad por estímulos químicos en la cual sustancias diversas contenidas en los alimentos o en las bebidas interaccionan con los receptores gustativos ubicados en la superficie apical de las células neuroepiteliales. Estas células reaccionan ante cinco estímulos básicos: dulce, salado, amargo, acido y umami (que significa sabroso en japonés) es el sabor de ciertos aminoácidos (p.ej. glutamato, aspartato y compuestos relacionados) y es común en los esparragos, los jitomates, el queso y la carne. El aminoácido L- glutamato es el responsable del sabor umami y el gen codificador del receptor del glutamato (mGluR4) se ha identificado y clonado el glutamato monosódico, añadido a muchos alimentos para aumentar su sabor (y el ingrediente principal de la salsa de soja), estimula los receptores umami.

Transducción ácida
La estimulación de los receptores gustativos inicia una cascada de reacciones dentro de las células neuroepiteliales que incluyen la activación de proteínas G acopladas con los receptores, lo que conduce al aumento de la actividad de las enzimas intracelulares que generan respuesta de segundo mensajero. Los segundos mensajeros a su vez, activan canales iónicos de membrana que aumenta la concentración intercelular de Ca2+, sea por la entrada de la celular de Ca2+ extracelular o por liberación de los depósitos intracelulares.las concentraciones elevadas de Ca2+ estimula la liberación de moléculas neurotransmisoras que generan impulsos nerviosos a lo largo del nervio sensitivo post-sináptico.
Algunos hallazgos recientes indican que sensaciones gustativas diferentes son generadas por moléculas distintas de segundos mensajeros. Los corpúsculos que están un poco más atrás de los salados y hacia los lados detectan los estímulos ácidos.
Los sabores ácidos son transmitidos por los iones H+.
Transducción salada
Ocurre un proceso similar a las otras transducciones.
Algunas regiones de la lengua responden más a ciertos sabores que otras, los corpúsculos que le siguen justo a los lados y hacia atrás de la punta detectan los estímulos salados.
Los sabores salados son transmitidos por el Na+ en la comida. La proteína receptora de la sustancias saladas no es real mente un receptor, y sí un canal de Na+ (figura7.11a).
Transducción amarga
Por ejemplo un aumento de la concentración de inositol 1, 4, 5-trifosfato (IP3) estimula la liberación de Ca2+ desde los depósitos intracelulares y tiene a su cargo las transducción del sabor amargo.
Los corpúsculos gustativos de las papilas calciformes detectan los estímulos amargos y umami.
Los aminoácidos y las moléculas relacionadas transmiten la sensación de umamai. Por el contrario un amplio rango de moléculas orgánicas puede transferir el sabor amargo, que incluyen compuestos como la cafeína, la nicotina y la quinina.
Estos canales de Na+ son permeables a los H+, por lo que puede desempeñar un papel importante en la percepción de los sabores amargos. Debido a que los iones Na+ y los H+ compiten por el canal, estos canales son probablemente importantes para la recepción del “amargo” solamente en especies con niveles de Na+ en la saliva relativamente bajos. Por consiguiente, los hámsters, que tienen poco Na+ en la saliva, utilizan estos canales para detectar el sabor amargo, mientras que en los humanos y las ratas, que tienen cantidades de Na+ relativamente altas, saborean el amargo a través de otros mecanismos.
Se han propuesto diferentes mecanismos de transducción del sabor amargo dependiendo de las especies investigadas. La figura 7.11b resume uno de estos mecanismos posibles, que fue descrito por primera vez para las células receptoras del gusto de las salamandras. Estos receptores gustativos detectan el sabor amargo a través del canal de K+ localizado apicalmente y que se bloquea directamente por el H+. El bloqueo de estos canales de K+ conduce a la despolarización de las células del gusto, produciendo finalmente la liberación del neurotransmisor. En las ranas, sin embargo, las células del gusto contienen canales de Ca2+ dependientes del H+ y transportadores de H+ que se cree que están implicados en la detección del sabor amargo, aunque las proteínas implicadas específicas no se han secuenciado todavía. Estudios moleculares recientes en los mamíferos han sugerido que los canales iónicos sensibles al ácido (ASIC) pueden se importantes en la detección del sabor amargo. Perece que estos canales son canales de Na+ que se abren en respuesta a los cambios de pH.
El sabor umami, que se produce por el L-glutamato y otros aminoácidos presentes en las comidas, así como adictivo MSG, puede ser detectado por dos clases diferentes de receptores: un tipo que es similar a los receptores que detectan el sabor dulce y el otro que es similar a los receptores de glutamato que se encuentran en el cerebro. Cuando el glutamato se une a este recetor de glutamato modificado, el receptor experimenta un cambio en la conformación, activándose una proteína G asociada. La proteína G activa, entonces, una fosfodiesterasa que degrada el AMPc en AMP. Parece que la disminución de AMPc disipa la liberación del neurotransmisor, aunque las rutas precisas no han sido todavía identificadas.
Transducción dulce
En cambio la transducción de un sabor dulce se acompaña de un aumento se la concentración del cAMP que causa la despolarización de la membrana celular mediante el cierre de los canales de k+.
En general los corpúsculos gustativos de la punta de la lengua detectan estímulos dulces.
Los azucares y las moléculas orgánicas relacionadas transmiten los sabores dulces.
La ruta de transducción de la señal para los receptores del sabor dulce se resume en la figura 7.11c. Las sustancias dulces como los azucares se unen a los receptores acoplados a proteínas G en la superficie apical de la célula, y se activa la proteína G gusductina, que envía la señal a través de la vida de transducción de la señal mediada por el adenilato ciclasa. Los receptores para el sabor dulce han sido recientemente identificados en los ratones. Estos receptores son sentibles a muchos tipos de sustancias dulces, que incluyen monosacáridos, polisacáridos, endulcorantes fuertes y algunos aminoácidos.
Esto sugiere que los receptores para el sabor dulce son receptores de amplio espectro que no diferencian entre sustancias dulces alternativas. Algunas sustancias dulces (particularmente edulcorantes artificiales fuertes como la sacarina) pueden activarse a través de la cascada de transducción de la señal mediada por IP3, que provoca el cierre de los canales de K+ y la despolarización de la célula receptora.
OLFATO

En los animales terrestres, el olor puede ser definido como la quimiorrecepción de sustancias transportadas por el aire. Sin embargo, para ser detectadas, estas sustancias deben primero estar disueltas en una capa acuosa de moco que recubre a un tejido especializado, el epitelio olfativo. En los seres humanos, este tejido está localizado en el fondo de las fosas nasales.

a) El epitelio olfativo es responsable de nuestro sentido del olfato y mucho de lo que paladeamos en la comida es el resultado de sustancias volátiles que llegan a este tejido. b) El epitelio olfativo está compuesto por células de soporte, células basales y células olfativas, que son los receptores sensoriales.
Química de los olores
Las membranas de estas células contienen receptores específicos de moléculas de olor. La unión de una molécula de olor a su receptor inicia una serie de fenómenos que involucran al AMP cíclico. La integración de numerosas señales modifica el potencial de membrana y de acuerdo a esa modificación, finalmente la célula olfativa da inicio o no a los potenciales de acción y también determina la frecuencia con que ellos ocurren.
Los seres humanos somos capaces de discriminar aproximadamente diez mil olores diferentes. Las neuronas sensoriales olfativas llevan información a través de una vía multisináptica a zonas específicas de la corteza cerebral. A partir de las señales recibidas de los varios tipos celulares diferentes, el cerebro construye un "cuadro" de un olor.
Transducción olfativa
Las glándulas olfatorias representan una característica distintiva de la mucosa olfatiria
Las glándulas olfatorias (glándulas de Bowman), una característica distintiva de la mucosa, son las glándulas tubuloalveolares serosas ramificadas que envían sus secreciones proteináceas hacia la superficie olfatoria a través de conductos. Los gránulos de lipofuscina prevalecen en las células glandulares y en conbinacion con los granulos de lipofuscina de las células sustentaculares del epitelio olfatorio, le imparten una coloración pardo amarillenta a la mucosa. De los adenómeros glandulares parten conductos excretores cortos formados por células cubicas que atraviesan la lamina basal hacia el epitelio olfatorio para seguir hasta la superficie epitelial, donde vierten su secreción.
La secreción serosa de las glándulas olfatorias actúa como trampa y solvente para las sustancias odoríferas. El flujo constante desde las glándulas libra a la mucosa de los restos de las sustancias odoríferas detectadas de modo que los olores nuevos se puedan percibir conforme aparecen.
Los receptores olfativos son proteínas G
Los receptores olfativos son receptores acoplados a proteínas G, similares en muchos aspectos a las implicadas en la comunicación hormonal. Las proteínas receptoras olfativas son miembros de una gran familia multigénica, y todos los genomas de vertebrados que han sido secuenciados hasta la fecha contienen muchos genes que codifican para receptores olfativos (por ejemplo el genoma del ratón contiene al menos 1000 genes potenciales para receptores olfativos). Cada receptor olfativo expresa solamente una clase de proteína receptora del olor a pesar de este amplio rango de posibles proteínas.
Cuando una molécula odorífera se une a un receptor olfativo, el receptor experimenta un cambio conformacional que envía la señal a una proteína G asociada, Golf. Golf activada señal por medio de la adenilato ciclasa, activándose la ruta de transducción de la señal (mostrada en la figura7.7), que finalmente dará lugar a un potencial generador despolarizante. Si la despolarización es suficiente grande, los potenciales de acción se disiparan en las dendritas de la neurona olfativa receptora. Es necesario darse cuenta que estos potenciales de acción viajan hacia el cuerpo celular de esta neurona bipolar, contrariamente a la organización descrita para la neurona motora, en la que el potencial de acción siempre viajara alejándose del cuerpo celular. Estos potenciales de acción finalmente son transmitidos hacia el otro extremo de la neurona, donde los terminales axónicos sinaptan con las neuronas del bulbo olfatorio del cerebro.
Hay indicios que sugieren que la ruta adicional de la transducción de la señal puede también desempeñar un papel importante en la detección del olor en los mamíferos. Por ejemplo, algunos receptores olfativos están acoplados a proteínas G que activan una cascada como señal de transducción mediada por una fosfolipasa C (PLC), en la que la fosfolipasa C hidroliza fosfatidilinositol-4,5-bifosfato (PIP2) en la membrana plasmática, dando lugar a inositol trifosfato (IP3) y diacilglicerol (DAG), que provoca un aumento intracelular de Ca+, haciendo que los canales de Cl- en la membrana plasmática se abran. Sin embargo, como en la transducción de la señal mediado por AMPc, el resultado final es una cascada de la transducción de la señal mediada por PLC es la despolarización de la celula, para el disparato de los potenciales de acción.

Michael H. Ross (†), Wojciech Pawlina, 2009Texto y atlas color con biología celular y molecular, 5aedición, Ed. medica panamericana, México. Cap.16 y 19.
Christopher D. Moyes; Patricia M. Schulte. Principios de fisiología animal. Pearson educación, S.A., Madrid, 2007. cap7
http://biologia-jct.iespana.es/curtis/libro/c48b.htm










No hay comentarios:
Publicar un comentario